אייסקיור מאותתת על מומנטום עסקי בארה"ב, בניסיון להציל את המניה
18 דצמבר, 2025
לאחר אישור FDA לטיפול בסרטן שד, בחברה צופים מכירות שיא בצפון אמריקה. המניה מזנקת, אך עדיין מתחת למחיר המינימום של בורסת נסד"ק
חברת אייסקיור מדיקל (IceCure) הודיעה אתמול (ד') כי היא מצפה לדווח על שיא מכירות ברבעון הרביעי בצפון אמריקה, בעקבות אישור ה-FDA שהתקבל באחרונה למערכת ה-ProSense לטיפול בסרטן שד בסיכון נמוך. בהודעה לא נמסרו נתונים כספיים מספריים, אך החברה ציינה כי ברבעון הרביעי, שעל הכנסותיו תדווח בינואר, היא צפויה להציג מכירות שיא בצפון אמריקה.
ההודעה נתפסת כמהלך שנועד לאותת למשקיעים על מומנטום עסקי ראשוני לאחר קבלת האישור הרגולטורי, וזאת על רקע מצבה של המניה בשוק. מניית אייסקיור נסחרת כיום במחיר של כ־0.68 דולר (שווי שוק של 46.5 מיליון דולר), לאחר עלייה של כ־8.6% במסחר אתמול בנאסד"ק בעקבות ההודעה, אך עדיין מתחת לרף המינימום של דולר אחד. לאחרונה קיבלה החברה התראה מהבורסה על אי־עמידה בדרישות הסף, והיא נדרשת להחזיר את מחיר המניה מעל הרף כדי להימנע מצעדים רגולטוריים.
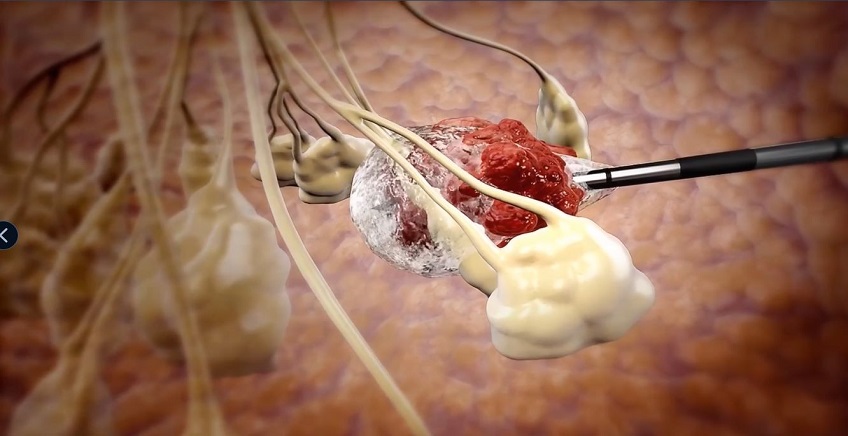
אישור ה-FDA, שהתקבל באוקטובר האחרון, מהווה את אבן הדרך הרגולטורית המרכזית בתולדות החברה. מדובר באישור הראשון שניתן לטיפול בסרטן שד באמצעות קריואבלציה – הקפאת הגידול – והוא מתייחס לנשים מעל גיל 70 שאובחנו עם סרטן שד מוקדם ובסיכון נמוך. האישור התבסס על מחקר ICE3, שהציג שיעור של מעל 96% ללא חזרת מחלה וללא תופעות לוואי חמורות.
מערכת ה-ProSense שפיתחה אייסקיור מאפשרת השמדה זעיר-פולשנית של גידולים באמצעות הזרמת חנקן נוזלי דרך מחט דקיקה, בהנחיית הדמיה. ההליך אינו מחייב ניתוח, מתבצע בזמן קצר יחסית ונועד להציע חלופה לכריתה כירורגית במקרים מתאימים.
מנכ"ל החברה, אייל שמיר, אמר עם קבלת האישור כי “לאחר השלמת שלב הרגולציה, אנחנו עוברים כעת לשלב הביצוע ומתמקדים בהאצת המסחור בארצות הברית. הטיפול שלנו מציע חלופה ללא ניתוח לנשים שאובחנו בסרטן שד מוקדם”.
התגובה החיובית של השוק להודעה האחרונה מצביעה על כך שהמסר עבר: אייסקיור מבקשת להבהיר כי אישור ה-FDA מתחיל להתגלגל לפעילות מסחרית – וכי השלב הבא בסיפור שלה אמור להימדד כבר בהכנסות.
פורסם בקטגוריות: חדשות , מכשור רפואי


