חברת אייסקיור (IceCure Medical) הישראלית, שפיתחה מערכת זעיר-פולשנית להשמדת גידולים סרטניים באמצעות הקפאתם בחנקן נוזלי, הודיעה בסוף השבוע כי ה-FDA אישר את השימוש במערכת ה-ProSense של החברה לטיפול בסרטן שד. ההתווייה מתייחסת לנשים מעל גיל 70 שאובחנו עם סרטן שד בשלבים מוקדמים ובעל סיכון נמוך. לפי הערכת החברה, מדי שנה מאובחנות בארצות הברית כ-36 אלף נשים עם סוג סרטן השד הכלול בהתווייה.
האישור מהווה את אבן הדרך הרגולטורית המשמעותית ביותר בתולדות אייסקיור, שכן זהו הטיפול הראשון והיחיד המבוסס על טכנולוגיית הקפאה ("קריואבלציה") שקיבל אישור FDA לטיפול בסרטן שד. מניית החברה הגיבה להודעה בעלייה של למעלה מ-17% במסחר המאוחר בנאסד"ק.
האישור מתבסס על תוצאות המחקר הקליני ICE3 שערכה החברה. זהו המחקר הנרחב ביותר שנערך עד כה לבחינת טיפול בקריואבלציה בגידולי שד בשלב מוקדם. המחקר, שנמשך חמש שנים והתקיים ב-19 מרכזים רפואיים בארצות הברית, כלל 206 נשים שאובחנו עם סרטן שד בסיכון נמוך. התוצאות הצביעו על שיעור של 96.3% ללא חזרת מחלה, ללא תופעות לוואי חמורות הקשורות למכשיר, ובשביעות רצון גבוהה מצד המטופלות – גם מבחינת התוצאה הקוסמטית. הממצאים פורסמו בכתב העת המדעי Annals of Surgical Oncology, והיוו בסיס מרכזי בהחלטת ה-FDA.
יתרון של 5 שנים על פני המתחרים
האישור התקבל לאחר הצבעה של ועדת מומחים (Advisory Panel) שהקים ה-FDA במיוחד לצורך זה. בהחלטת הוועדה צוין כי כל חברה מתחרה שתבקש לקבל אישור לשיווק מערכת דומה לא תוכל לעשות זאת במסלול המקוצר של 510(k), אלא תידרש לערוך ניסוי קליני עצמאי ולהציג נתונים קליניים מבוססים. בכך זוכה אייסקיור ביתרון תחרותי משמעותי – שנאמד בלפחות חמש שנים – על פני מתחרותיה הפוטנציאליות.
במקביל לאישור, החברה נערכת להקמת צוות מכירות בארצות הברית ולתחילת המסחור המסחרי של המערכת. כחלק מתנאי האישור, היא תבצע מחקר Post Market Study שייערך לאחר תחילת השיווק. באייסקיור רואים בכך יתרון אסטרטגי, מאחר שהמחקר צפוי להתבצע בשיתוף מוסדות רפואיים מובילים בארצות הברית ולתרום להטמעת הטכנולוגיה בשטח.
לחברה כבר קיים כיסוי ביטוחי ראשוני תחת קוד CPT3, המאפשר החזר חלקי על הטיפול, צעד שצפוי להקל על אימוץ השיטה בקרב בתי חולים ורופאים. בנוסף, למערכת של אייסקיור יש כבר אישור CE באירופה ואישור אמ"ר ממשרד הבריאות בישראל. עם זאת, באייסקיור מעריכים כי אישור ה-FDA יגדיל את קצב האימוץ גם בשווקים שבהם כבר קיים אישור רגולטורי, וכן יסייע לקידום קבלת אישור רגולטורי ביפן – אחד משווקי היעד המרכזיים של החברה.
בשיחה עם Techtime אמר מנכ"ל החברה, אייל שמיר: "המיקוד העיקרי שלנו בשנים האחרונות הוא בסרטן השד, מאחר שלמערכת שלנו יש יתרון טכנולוגי וכלכלי מובהק בסוג זה של סרטן. לאישור הזה יש משמעות רחבה לכל תחום הטיפול בסרטן שד. כעת, לאחר קבלת האישור הרגולטורי, אנחנו עוברים לשלב הביצוע ומתכוונים להאיץ את מאמצי המסחור בארצות הברית. הטיפול שלנו מציע חלופה ללא ניתוח לנשים מעל גיל 70 שאובחנו בסרטן שד מוקדם".
הזרמת חנקן נוזלי ישירות לתוך הגידול
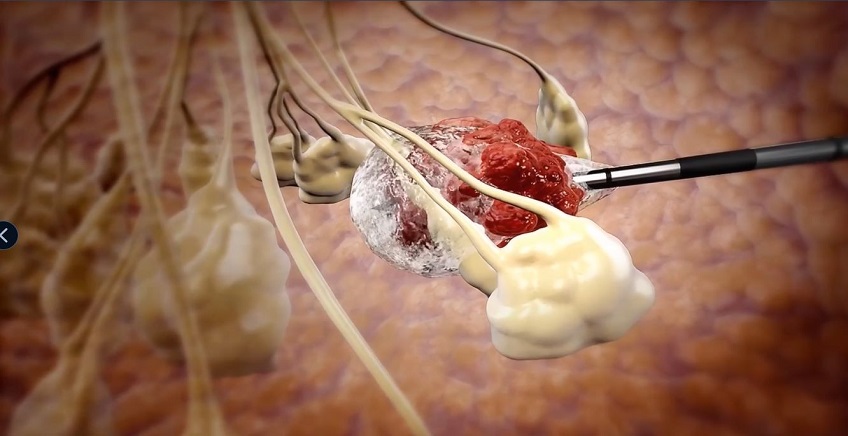
אייסקיור, שנוסדה בשנת 2006, פיתחה מערכת המבוססת על טכנולוגיית Cryoablation, שבה משמידים את הגידול באמצעות הקפאה מבוקרת. ההליך מתבצע באופן זעיר-פולשני, באמצעות החדרה של מחט דקיקה – המוגנת ב־11 פטנטים – אותה מנווט הרופא אל הגידול בהנחיית אולטרה-סאונד, או בהדמיית CT במקרה של גידולים בכבד, בריאות או בעצמות. עם הגעת המחט לגידול, מוזרם אליה חנקן נוזלי שמקפיא את הרקמה הסרטנית מבלי לפגוע ברקמות הבריאות שסביבה.
ההליך נמשך כ־20 עד 40 דקות בלבד, מתבצע לרוב בהרדמה חלקית ואינו מחייב חדר ניתוח. בניגוד למרבית הטיפולים המתחרים, המתבססים על גזים נדירים כמו ארגון והליום – יקרים יותר ובעלי טווח הקפאה מוגבל – מערכת ה־ProSense פועלת באמצעות חנקן נוזלי, שמאפשר טיפול יעיל יותר עם פחות מחטים ופחות סיבוכים. חשוב לציין כי טיפול בקריואבלציה יעיל בעיקר בגידולים בשלבים מוקדמים, ולכן אבחון מוקדם הוא תנאי קריטי להצלחת ההליך.
בשנים האחרונות ממקדת אייסקיור את מאמציה העסקיים והקליניים בהתווייה לטיפול בסרטן שד מוקדם, מתוך הערכה כי במקרים אלו למערכת שלה יש את היתרונות היחסיים הבולטים ביותר – הן בזכות שיעורי ההחלמה הגבוהים, והן בזכות העובדה שהטיפול אינו כרוך בכריתה חלקית של השד ואינו פוגע במראהו.
הירשמו לניוזלטר שלנו
הרשמה לניוזלר השבועי