שתי חברות מכשור רפואי ישראליות דיווחו הבוקר לבורסה על קבלת אישור FDA (מנהל התרופות והמזון האמריקני) למוצריהן. חברת בריינסווי (BrainsWay), שפיתחה קסדה לטיפול בלתי פולשני בהפרעות מוח נפוצות, הודיעה כי קיבלה את אישור ה-FDA למוצר שלה לטיפול בהפרעה טורדנית כפייתית (OCD), ואילו איתמר מדיקל (Itamar Medical), שפיתחה מכשיר לאבחון דום נשימה בשינה, דיווחה כי קיבלה את אישור ה-FDA לדור הבא של המוצר שלה, ה-WatchPat 300.
אישור ה-FDA, המתקבל לאחר סדרה של ניסויים קפדניים תחת פיקוחו של המנהל האמריקני, מעניק למעשה גושפנקא לבטיחות וליעילות של תרופה או מכשור רפואי כלשהם, ומתיר לחברה להתחיל ולשווק ולמכור את המוצר בארצות הברית, השוק הרפואי הגדול בעולם. בעקבות קבלת האישורים מזנקות מניותיהן של בריינסוויי ואיתמר מדיקל הבוקר בבורסת תל אביב.
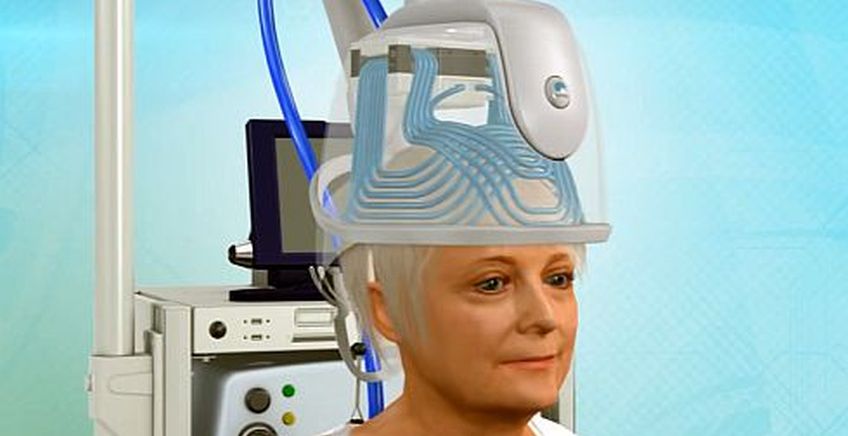
קסדה לטיפול בהפרעות מוח
חברת בריינסוויי מהר חוצבים בירושלים פיתחה קסדה בשם Deep TMS המבצעת גירוי חשמלי לטיפול בלתי פולשני בהפרעות נוירולוגיות ופסיכיאטריות נפוצות דוגמת דיכאון, סכיזופרניה, אפילפסיה, מאניה-דיפרסיה ועוד. בקסדה מותקנים סלילים אלקטרומגנטיים המפעילים זרמים חשמליים המשפיעים על קליפת המוח (Cortex) ומסייעים לטפל בהפרעות.
התקבל על פי בקשת החברה בהתבסס על ניסוי רב-מרכזי, אשר תוצאתו הראשית הראתה כי בתום 6 שבועות של טיפול בחולי OCD חל שיפור סטטיסטי-מובהק בסימפטומים של המחלה בקרב הקבוצה שקיבלה טיפול באמצעות המערכת של בריינסוויי בהשוואה
אחד המפתחות לצמיחה של החברה הוא הרחבת ההתוויות לשימוש במוצר שלה בשווקים השונים. השוק העיקרי של החברה הוא השוק האמריקני. עד כה המוצר שלה היה מאושר לשיווק בארצות הברית לטיפול בדיכאון בלבד, תחום שבו יש לחברה מתחרים. כעת, כאמור, מתרחבת ההתוויה לטיפול גם בהפרעה טורדנית כפייתית (OCD), וזאת לאחר השלמת ניסוי קליני שהציג שיפור סטטיסטי-מובהק בסימפטומים של המחלה. בבריינסווי מציינים כי זה המוצר הראשון, המתבסס על גרייה חשמלית, שאושר לשיווק בארצות הברית על ידי ה-FDA, מה שיעניק לחברה עמדת זינוק משמעותית למול חברות מתחרות ועשוי להגדיל את היקף ההזמנות של החברה בארצות הברית. באירופה מאושרת הקסדה לשימוש בטיפול במגוון תסמונות כדוגמת סכיזופרניה, הפרעה פוסט טראומטית, דיכאון חמור, הפרעה דו קוטבית ועוד.
בעקבות ההודעה מזנקת מניית בריינסוויי בשיעור של כ-15%-20% והיא נסחרת לפי שווי של 336 מיליון שקל. הכנסות החברה ברבעון הראשון של 2018 הסתכמו ב-3.6 מיליון דולר, עלייה של 68% לעומת הרבעון המקביל ב-2017. בשורה התחתונה, ההפסד הנקי ברבעון עמד על 1.02 מיליון דולר, בהשוואה להפסד של 1.9 מיליון דולר ברבעון המקביל בשנה שעברה.
אבחון ביתי של דום נשימה בשינה
שבוע לאחר שהצהירה על כוונתה לרשום את מניות החברה למסחר בנסד"ק, הודיעה הבוקר איתמר מדיקל, שפיתחה ערכה ביתית לאבחון וטיפול בדום נשימה בשינה בשם Watch-Pat, כי קיבלה את אישור ה-FDA לשיווק גרסה חדשה ומשודרגת של המוצר שלה. על פי איתמר מדיקל
ה-Watch-PAT הינו מכשיר המולבש על כף ידו של המטופל כמו שעון ומודד באמצעות חיישן רגיש המורכב על אצבעו של המטופל את השינויים במהלך השינה בנפח זרימת הדם בקצה האצבע. המכשיר למעשה מודד את מספר הפסקות השינה ביחס לזמן השינה האמיתי ובכך מסייע לאבחן בצורה מדויקת יותר תסמונת של דום נשימה בשינה.

המכשיר מספק אינפורמציה ואינדקסים נשימתיים, קצב לב, אנליזה של שלבי שינה (שינה קלה ושינה עמוקה ושנת חלום), עוצמת נחירה ותנוחת גוף. על פי החברה, המכשיר הוכיח 90% דיוק באבחנת דום נשימה בשינה. דום נשימה בשינה עשוי להעיד על תופעות שונות כגון התפתחות טרשת עורקים, הפרעות בשינה, מצבי לחץ, בעיות אין-אונות, סיבוכים בהריון ועוד.
הודות לפשטותה של הבדיקה, ניתן לבצע אותה לא רק במעבדת שינה אלא באופן ביתי על ידי המטופל. כיום כשני שלישים מסך הבדיקות מתבצעות במעבדות שינה, והמטרה של איתמר מדיקל היא להפוך את בדיקות השינה הביתיות לסטנדרט מקובל בקרב הרופאים, המטופלים והמבטחים בארצות הברית.
לדברי החברה הגרסה החדשה, ה-Watch-PAT 300, הינו בעל גוף קטן וקל יותר מהגרסה הקודמת ומציג יכולות משופרות של העברת נתונים ואף כולל תשתית שתאפשר בעתיד להפוך את התקשורת לאלחוטית.
בשבוע שעבר הודיעה החברה כי הגישה לרשות לניירות ערך האמריקנית (ה-SEC) את מסמכי הבקשה לרישום מניות החברה למסחר בנסד"ק. לא מדובר בהנפקת מניות לציבור (IPO), אלא לרישום למסחר בנסד"ק באמצעות ADR (American Depository Receipt), מעין תעודה אשר נסחרת בבורסה האמריקנית ועוקבת אחר מניית החברה בבורסת תל אביב. מטרת המהלך הינה לחזק את בסיס המשקיעים בחברה ולאפשר לגופי השקעה אמריקניים וזרים להשקיע במניה וכך להגדיל את היקפי המסחר במניה ואת שווי השוק של החברה.